Peta Konsep Sifat Fisis Senyawa Senyawa Ion Senyawa Kovalen Logam. Dua gaya yang pertama disebut gaya van der walls Sulaiman 2008.

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube
Ion-ion ini memiliki muatan berlawanan negatif dan positif.

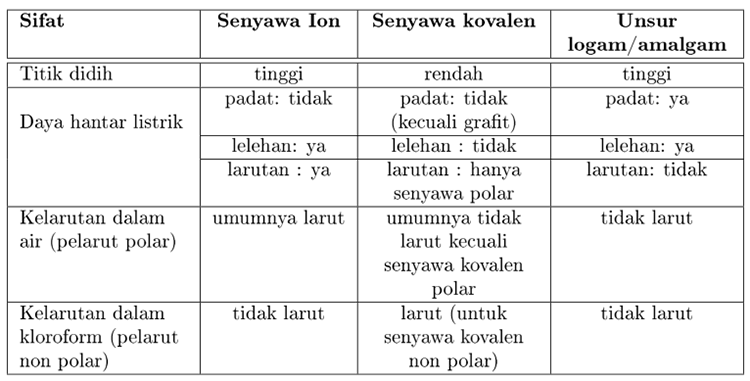
. Leleh tinggi 350oC sering sampai 1000oC. Di sisi lain senyawa kovalen non-logam yang terikat bersama-sama dan terdiri dari dua elektron yang dibagi. Perbedaan sifat fisik yang paling menonjol antara senyawa kovalen dan senyawa ion adalah titik leleh dan penghantar listrik.
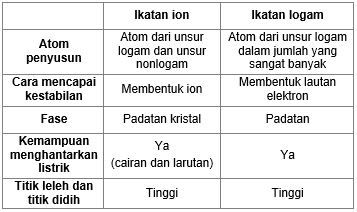
Logam magnesium mudah dibentuk dengan memukulmenekannya sedangkan magnesium fluorida akan hancur jika dipukul. Senyawa ionik adalah senyawa yang atom-atomnya berikatan secara ionik. Titik didih berkaitan dengan gaya tarik-menarik antar partikel kohesi.
Senyawa ion yang terbentuk dari interaksi elektrostatik yang kuat antara ion yang menghasilkan titik leleh yang lebih tinggi dan konduktivitas listrik dibandingkan dengan senyawa kovalen. Perbedaan sifat fisik senyawa ion kovalen dan logam. Tidak mudah patah dan mudah dibentuk.
Ion positif dan negatif dalam kristal senyawa ion tidak bebas bergerak karena terikat oleh gaya elektrostatik yang kuat. Sifat Fisis Senyawa Ion. Senyawa kovalen memiliki ikatan di mana elektron dibagi antara atom.
Perbedaan ketiga perbedaan ini antara lain disebabkan oleh kekuatan ion. Beberapa sifat khas senyawa ion antara lain. Titik leleh senyawa kovalen cenderung lebih rendah dari senyawa ion.
Berbeda dengan senyawa ionik senyawa kovalen tidak mempunyai elektron yang bebas bergerak. Kristal ion tersebut terdiri dari ion-ion positif dan ion-ion negatif. Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka.
Pada percobaan kali ini mengenai pengujian perbandingan sifat senyawa ion dan senyawa kovalen dengan menguji 7 bahan uji dari beberapa perbandingan diantaranya. Ditentukan oleh gaya elektrostatik yang kuat ke segala arah Dalam senyawa ion ion positif akan dikelilingi sejumlah ion negatifbegitu pula sebaliknya Dalam fase padat ikatan antar ion-ion positif dan negatif ini membentuk suatu pola atau struktur teratur yang disebut. Umumnya senyawa ion dapat larut dalam air.
Sedangkan kovalen pada suhu kamar berupa cairan atau gas. Sedangkan senyawa ion banyak yang tidak membakar. Perbandingan beberapa sifat senyawa kovalen dan ion.
Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Pada perbandingan titik leleh mengujikan 5 bahan uji yakni urea naftalena NaCl KI serta MgSO4. Sedangkan perbedaan sifat fisika dan kimia dari senyawa ion adalah titik leleh tinggi berwujud padatan pada suhu.
Titik didih dan titik leleh yang tinggi. Perbedaan Kunci - Senyawa Ionic vs Kovalen. Banyak perbedaan dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopisnya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih.
Perbandingan sifat senyawa kovalen dan senyawa ion. Beberapa sifat senyawa ion antara lain. Perbedaan antara senyawa ionik dan kovalen dapat membingungkan.
Satu atom memberikan satu atau lebih dari elektron. Oleh karena itu pola ikatan mereka dapat. Secara umum C fisis senyawa ion dipengaruhi oleh struktur kristal ion tersebut.
Jika dibandingkan antara hasil percobaan dengan sifat-sifat kimia dan fisika senyawa ion dan senyawa kovalen pada buru referensi keduanya terdapat kesesuaian. Jadi senyawa kovalen tidak bisa menghantarkan listrik. Karena berbagi elektron mereka menunjukkan sifat fisik karakteristik yang meliputi.
Dari percobaan diperoleh hasil bahwa perbedaan sifat fisika dan kimia dari senyawa kovalen adalah titik leleh rendah berwujud gas atau cair pada suhu kamar larut dalam pelarut non polar umumnya terbakar dan banyak yang berbau. Perbandingan sifat fisik yang paling menonjol antara senyawa kovalen dan senyawa ion adalah titik leleh kelarutan pengantaran listrik. Oleh karena itu pola ikatan dapat dianggap sebagai.
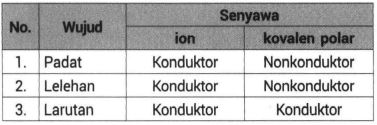
Beberapa sifat senyawa kovalen yaitu meliputi. Dalam keadaan cair atau terlarut dalam air senyawa ion dapat menghantarkan arus listrik. Beberapa sifat khas senyawa ion antara lain.
Senyawa ion dapat menghantarkan arus. Perbandungan sifat senyawa kovalen dan senyawa ion. Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik.
Urea naftalena dan isopropil alkohol merupakan senyawa kovalen. Definisi dasar dari suatu senyawa ionik adalah bahwa mereka adalah molekul yang terdiri dari ion bermuatan. Umumnya senyawa ion dapat larut dalam air.
Titik didih dan titik leleh senyawa logam lebih tinggi dari senyawa ion senyawa ion lebih tinggi dari senyawa kovalen. Adanya molekul air akan mengakibatkan ion-ion positif dan ion negatif akan tercerai berai terpecah karena gaya tarik molekul-molekul air. Adanya molekul air akan mengakibatkan ion-ion positif dan ion negatif akan tercerai berai terpecah karena gaya tarik molekul-molekul air.
Dapat menghantarkan listrik dan panas. No Senyawa kovalen Senyawa ion 1 Kebanyakan menunjukkan titik Kebanyakan menunjukkan titik leleh rendah. Tabel berikut menyangkut berbagai sifat fisik dari 5 jenis zat.
2 Umumnya cairan atau gas pada Semuanya dalah padatan pada suhu. Memiliki Titik Didih dan Titik Leleh yang Tinggi. Diperlukan suhu yang tinggi agar ion-ion memperoleh energi kinetik yang cukup untuk mengatasi gaya elektrostatik.
Karena ada dua macam ikatan ion dan kovalen maka senyawaan-senyawaan kimia dapat dikelompokkan berdasarkan jenis ikatan yang terdapat dalam molekul senyawaan kedalam dua kelompok yaitu senyawaan ion dan senyawaan kovalen. Nahh demikian perbedaan sifat fisik dari Senyawa Ion Senyawa Kovalen dan Logam ya otakers Semoga bermanfaat yah. Secara umum senyawa ion mempunyai titik didih lebih tinggi dari kovalen.
Perbedaan Kunci - Senyawa Ionic vs Covalent. 213 Sifat Senyawa ion. Dari hasil percobaan yang telah dilakukan dapat diketahui sifat-sifat kimia dan fisika senyawa ion dan senyawa kovalen.
Banyak sekali senyawa kovalen yang mudah terbakar terutama yang mengandung hidrogen dan karbon. Di antara zat tersebut yang tergolong senyawa logam senyawa ion dan senyawa kovalen berturut-turut adalah. Berikut ini beberapa sifat fisis yang dipengaruhi oleh jenis ikatan yang dimiliki oleh suatu senyawa.
Ikatan ionik adalah ikatan yang dihasilkan dari perpindahan elektron dari satu atom ke atom lain. NaCl KI dan MgSO4 merupakan senyawa ion. Wujud senyawa ion pada suhu ruang biasanya adalah padat senyawa kovalen ada yang gas ada yang cair sedangkan logam biasanya padat.
Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh dan titik didih.

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Sebutkan 5 Contoh Perbedaan Antara Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Top 10 Perhatikan Data Fisik Senyawa A Dan B Berikut Bagaimana Jenis Ikatan Pada Kedua Senyawa Tersebut 2022

Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Sifat Fisis Senyawa Ion Senyawa Kovalen Dan Pdf

Buat Yang Kelas 10 Yuk Mengenal Ikatan Ikatan Kimia Dalam Atom

Modul Rumus Soal Sifat Fisis Senyawa Wardaya College
Sifat Fisik Senyawa Ion Kovalen Dan Logam Materi Kimia

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Pengertian Senyawa Kovalen Polar Dan Nonpolar Serta Perbedaannya

Pengertian Senyawa Kovalen Contoh Sifat Dan Rumus Senyawa

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset
Lakukan Analisis Apakah Perbedaan Dan Persamaan Da

Sebutkan Sifat Atau Ciri Senyawa Kovalen Dan Ion Brainly Co Id
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po

Perbedaan Senyawa Ion Senyawa Kovalen Dan Logam Utakatikotak Com

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id
